Семинар 1. Физическая химия и биохимия.
- Подробности
1. Отличительные свойства живых систем:
Сложность и высокоорганизованность
Структурная иерархия
Структура определяет функцию
Трансформация энергии
Воспроизводимость и подобие элементов
2. Химия - основа жизни
- Химическая природа биомолекул
- Органическая химия биологических реакций
- Физические законы материи

3. Элементный состав биомолекул
Почему преимущественно Н, C, O и N участвуют в формировании биомолекул?
4. Они обеспечивают многообразие связей и, как следствие, химических стректур и веществ
5. Ковалентные связи в орагических соединений образуют резонансные структуры, которые повышают прочность связей, обеспечивают перераспределение электронной плотности, участвуют в процессах переноса электронов по цепям
6. Высокоэнергетические соединения: макроэргические связи
7. Размеры и величины биоструктур
Органические биомолекулы имеют очень крупные размеры и молекулярный вес
8. Иерархия молекулярной организации биоструктур
Предшественики органических соединений (углекислый газ, вода, мочевина, азот, нитраты) в соединении образуют метаболиты (пируват, цитрат, сукцинат..), которые, в свою очередь, формируют строительные блоки (аминокислоты, моносахариды, жирные кислоты). Из строительных блоков образуются макромолекулы (белки, нуклеиновые кислоты), а они уже образуют супрамолекулярные комплексы (рибосомы, цитоскелет, мультиферментные комплексы). Те, в свою очередь, формируют органеллы клетки и саму клетку в целом
9. Свойства биомолекул отвечают условиям существования и выполняемым функциям
- Полярность и поляризованность
- Носители информации
- Уникальность 3-мерной структуры
- Слабые взаимодействия
Все эти свойства необходимы для поддержания структуры и обеспечения взаимодействий
10. Роль слабых взаимодействий
- Узнавание и функционирование биомолекул за счет структурной комплементарности
- Ограничивают диапазон условий существования ( необходимость катализа)
- Функционирование ферментов
11. Слабые взаимодействия: силы и расстояния
Они играют важную роль в структуре и функции боимолекул. Обратите внимание на расстояния, на которых действуют эти связи и какую силу связи они обеспечивают. Вспомните о водородных связях в молекулах воды и гидрофильных соединениях, ионных взаимодействиях заряженных частиц, гидрофобных связях липидов и жирных кислот. Важны и Ван-дер-Ваальсовы связи, действующие на сверхмалых расстояниях.
12. Ван-дер-Ваальсовы взаимодействия
- На очень малых расстояниях
- Быстро ослабевают связи с отдалением молекул друг от друга
- Ван-дер-Ваальсов радиус - это радиус молекулы, на котором проявляются Ван-дер-Ваальсовы взаимодействия, обеспечивает притяжение и оталкивание между молекулами и атомами.
13. Ионные / электростатические взаимодействия
Силы притяжения между противоположно заряженными полярными группировками:
- Не имеют четкой направленности, как у водородных связей
- Нет точного соответствия, как у в-д-в взаимодействий
14. Водородные связи
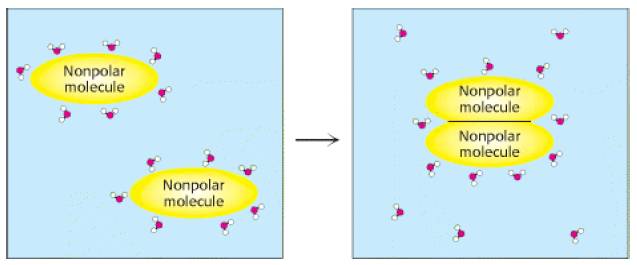
15. Гидрофобные взаимодействия
16. Вода, рН и ионные равновесия
17. Вода как идеальный растворитель
18. Диэлектрическая постоянная
D - мера способности растворителя к дипольным взаимодействиям вокруг ионов и снижения электростатического взаимодействия ионов.
Ионизация молекул вещества в растворе зависит от диэлектрической постоянной растворителя.
19. Гидрофобные взаимодействия
20. Ионизация воды
21. Kw - ионное произведение воды
Вода - слабый элетролит, количество Н+ (Н3О+) или ОН- в 1 литре чистой воды при 250С составляет 10-7 М
22. рН растворов
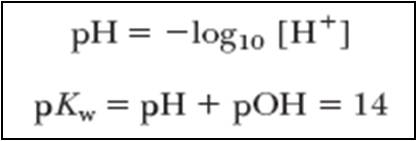
23. Константа диссоциации, сильные и слабые электролиты
24. Уравнение Хендерсона-Хассельбаха
Связывает рН с константой диссоциации и концентрацией ионов в растворе
25. Кривые титрования и буферные системы
Титрование - это аналитический метод определения количества кислоты в растворе.
Буферная система состоит из слабой кислоты и ее соли





















