Семинар 2. Термодинамика живых систем.
- Подробности
1. Основные понятия
Система: часть рассматриваемого пространства
Окружающая среда: всё остальное
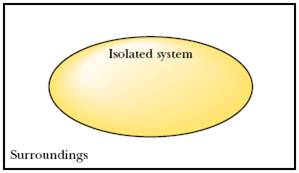
Изолированная система: нет обмена материи и энергии
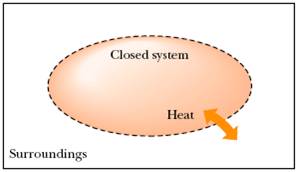
Закрытая система: может обмениваться энергией
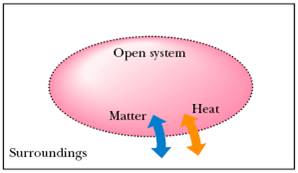
Открытая система: любой обмен возможен
 |
 |
2. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ : Общая энергия изолированной системы постоянна
E, или внутренняя энергия системы - это функция для описания переходов тепла и затрат на работу
Е - функция данного состояния системы, она не зависит от пути его достижения
Е изменяется только тогда, когда система обменивается с окружающей средой энергией в виде тепла или работы:
δЕ = Е2 - Е1 = q + w, где
q - тепло, поглощенное в систему
w - работа, совершенная над системой
Если работа механическая, то w = –PδV, и тогда
δE - это обмен теплом при постоянном объеме.
3. ЭНТАЛЬПИЯ. Удобная величина для условий постоянного давления
В биохимических процессах и реакциях (в растворах) обычно постоянно давление, но не объем, и тогда δЕ определяется не только изменением тепла
H = E + PV
Если P постоянно, то
δH = δE + PδV = q + w + PδV = q - PδV + PδV = q
и изменение энтальпии δН - это тепло, поглощенное системой при постоянном давлении.
4. СТАНДАРТНОЕ СОСТОЯНИЕ. Для сравнения параметров различных реакций
Стандартное состояние определяется как единица активности при концентрациях веществ(а) 1М (δH0 и δE0)
Изменение энтальпии (теплопоглощения) при биохимическом процессе измеряют с помощью калориметра.
Применение дифференциальной сканирующей калориметрии для исследования доменной организации белков и их взаимодействий.
5. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ . Для определения степени беспорядка системы
- Система свободно изменяется в сторону увеличения беспорядка и хаотичности (энтропии).
- Энтропия системы и ее окружения не изменяется в обратимых процессах и возрастает в необратимых.
- Все процессы в системе протекают в сторону установления равновесия, т.е. состояния с минимальной потенциальной энергией.
6. ЭНТРОПИЯ
Мера беспорядка
- Упорядоченное состояние - низкая энтропия
- Хаотичное состояние - высокая энтропия
dSreversible = dq / T, где dSreversible - приращение энтропии в обратимом процессе при температуре Т и переносе тепла (q)
7. ТРЕТИЙ ЗАКОН ТЕРМОДИНАМИКИ. Точка отсчета и абсолютная шкала энтропии
- Энтропия любого упорядоченного кристалла стремится к нулю при Т -> 00 K
- При T = 00 K энтропия равна 0
- При постоянном давлении теплоемкость вещества определяется как :
- Cp = dH/dT
*Сверхпроводники, Эйнштейновский конденсат - это интересно для общего развития
8. СВОБОДНАЯ ЭНЕРГИЯ ГИББСА. Для определения силы и направления реакций
G = H - TS
Для любой реакции при постоянном давлении и температуре:
δG = δH - TδS
Если δG = 0, реакция находится в равновесии
Если δG < 0, реакция протекает как написана
*Следствие: вечный двигатель невозможен
9. ФИЗИЧЕСКИЙ СМЫСЛ ТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН
Термодинамические параметры простых реакций:

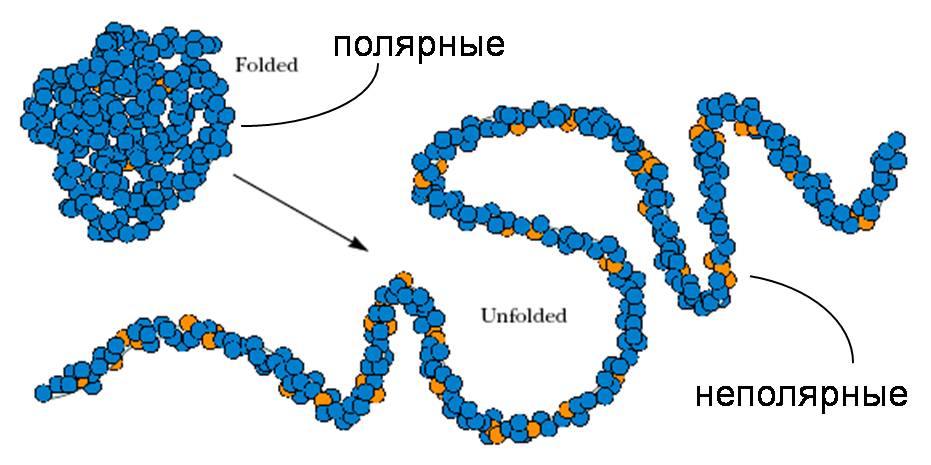
Структуризация и упорядочение воды экспонированными неполярными группами при денатурации белка приводит к отрицательному изменению энтропии:
10. СТАНДАРТНОЕ ИЗМЕНЕНИЕ ЭНЕРГИИ ГИББСА . Иной способ выражения константы равновесия

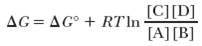
δG зависит от концентраций, рН, температуры и давления
δG0 существует при равновесных концентрациях субстрата и продукта 1М
При равновесии δG = 0 и дробь = Кравн ==>>
δG0 = -RT ln Kравн = -2,3 RT lg Kравн
*Кравн - это константа равновесия
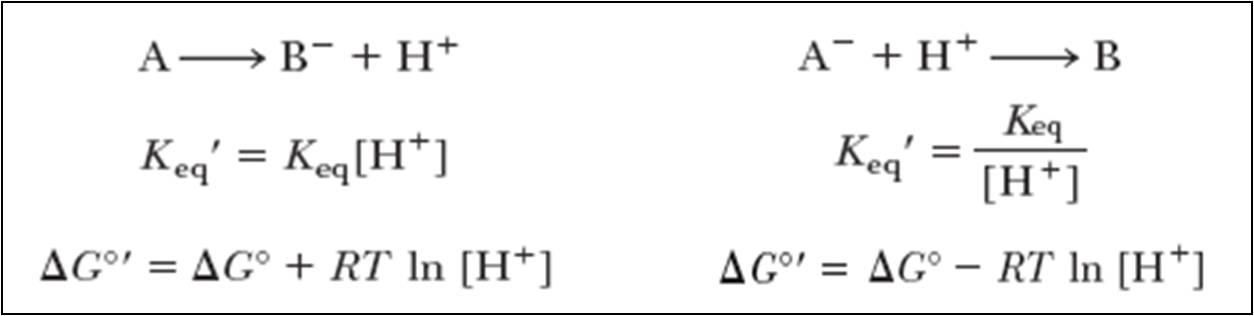
11. ЗНАЧЕНИЯ δG, δG’ и δGo’: ЭФФЕКТ рН
Стандартное состояние δG0 не имеет смысла для биохимических реакций с участием Н+ (рН = 0)
Для рН = 7 и Р = 1 атм используется измененное стандартное состояние, обозначаемое δG0’
12. ТРАНСФОРМАЦИЯ И ПЕРЕНОС ЭНЕРГИИ
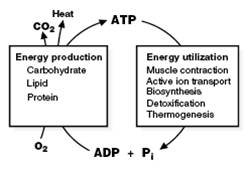
Расход АТФ составляет 65г в сутки!
Это делают два класса биомолекул:
Нуклеотидные коферменты (NADH, FADH2)
Высокоэнергетические фосфаты - изменение свободной энергии гидролиза более чем -25 kJ/mol
13. НУКДЕОТИДНЫЕ КОФЕРМЕНТЫ И ПЕРЕНОС ЭЛЕКТРОНОВ
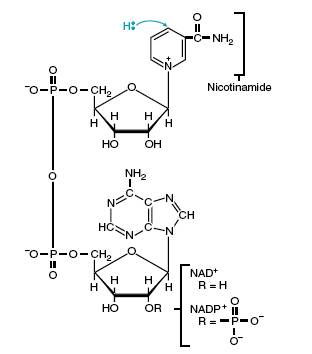 Окисление NАД+ и NADP+:
Окисление NАД+ и NADP+:
Перенос двух электронов в виде Н-
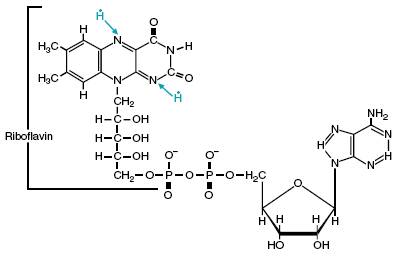 Окисление FАД:
Окисление FАД:
Перенос двух электронов в виде двух Н-.
14. АТФ - АНГИДРИДЫ ФОСФОРНОЙ КИСЛОТЫ
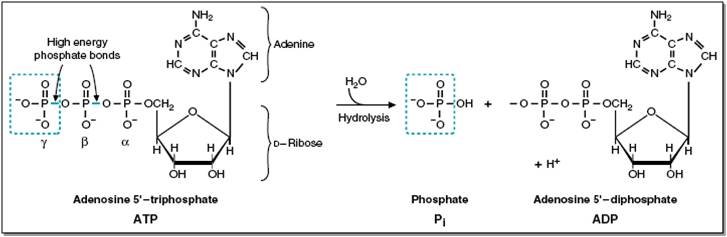
15. ВЫСОКОЭНЕРГЕТИЧЕСКИЕ ФОСФАТЫ >АТФ
16. ВЫСОКОЭНЕРГЕТИЧЕСКИЕ ФОСФАТЫ < АТФ
17. ПОТЕНЦИАЛ ПЕРЕНОСА ФОСФОРИЛЬНОЙ ГРУППЫ
Определяет тенденцию данной реакции к протеканию
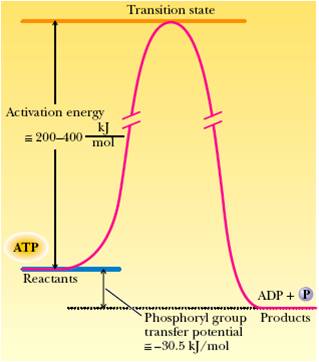
Уравнения переноса электрона:
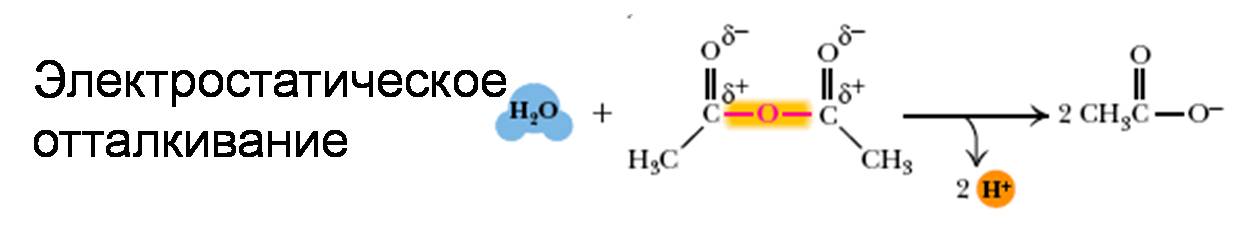
18. ГИДРОЛИЗ УКСУСНОГО АНГИДРИДА
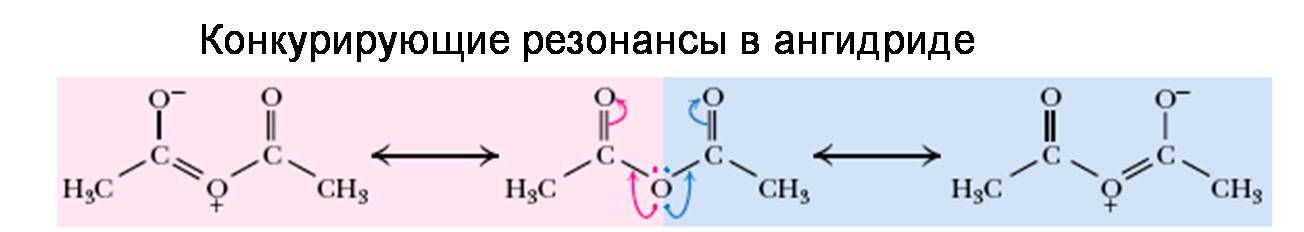
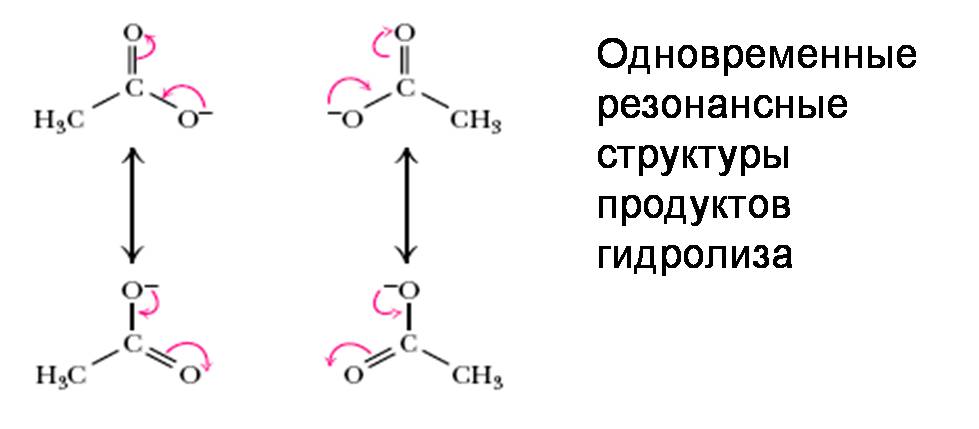
19. ГИДРОЛИЗ АТФ И АДФ
Большое изменение свободной энергии Гиббса благодаря:
- Электростатическому отталкиванию
- Резонансной и ионизационной стабилизации продуктов
- Энтропийный фактор
20. ГИДРОЛИЗ ФОСФО-КАРБОКСИЛЬНЫХ АНГИДРИДОВ
21. ГИДРОЛИЗ ФОСФОЕНОЛПИРУВАТА
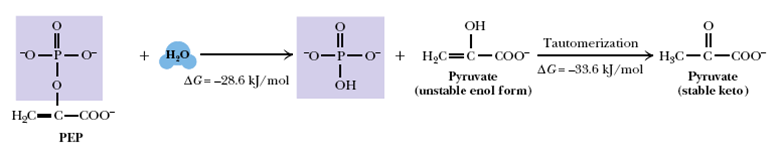
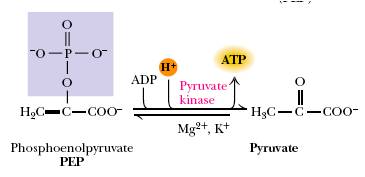
22. ВЛИЯНИЕ рН И Mg2+ НА ИЗМЕНЕНИЕ СВОБОДНОЙ ЭНЕРГИИ ГИДРОЛИЗА АТФ
23. ВЛИЯНИЕ КОНЦЕНТРАЦИЙ НА ЭНЕРГИЮ ГИДРОЛИЗА АТФ и АДФ










