Семинар 4. Аминокислоты и структура белка.
- Подробности
Часть первая: структура и классификация аминокислот.
1. Буфера и буферная емкость
| Кривая титрования фосфорной кислоты |
Диапазон буферной емкости некоторых биологических буферов |
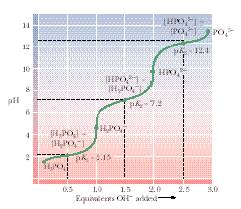 |
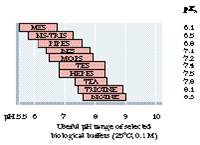 |
2. Оптические изомеры
3. Кислотно-основные свойства обобщенной аминокислоты с незаряженной боковой цепью
4. Простейшие аминокислоты
5. Алифатические (гидрофобные) аминокислоты
6. Цистеин образует дисульфидные мостики
7. Единственная иминокислота - пролин
8. Цис и транс-конфигурации пептидной связи
9. Оксиаминокислоты
10. Ароматические аминокислоты
11. Спектры поглощения и испускания ароматических аминокислот
12. Щелочные аминокислоты
13. Кислые аминокислоты и их амиды
Белки: уровни структурной организации, фолдинг, способы очистки и анализа, критерии гомогенности, определение первичной структуры и массы.
1. Четыре уровня организации структуры белка
2. Геометрия пептидной связи
Показано положение заторможенных плоскостей, образованных пептидными связями (два серых прямоугольника) и углы фи и пси, вокруг которых возможно вращение:
3. Карты Рамачандрана. Разрешенные и запрещенные углы фи и пси.
4. Первичная структура белка
Сиквенирование белка:
- методы расщепления пептидных связей
- тактика белкового сиквенирования
Разные ферменты способны расщеплять различные связи между аминокислотами в молекуле белка:
Cиквенирование ДНК:
- использование меченных нуклеотидов
- использование меченных праймеров
5. Вторичная и надвторичная структуры белка
Допустимые углы фи и пси:
для α-спиралей
для β-складок
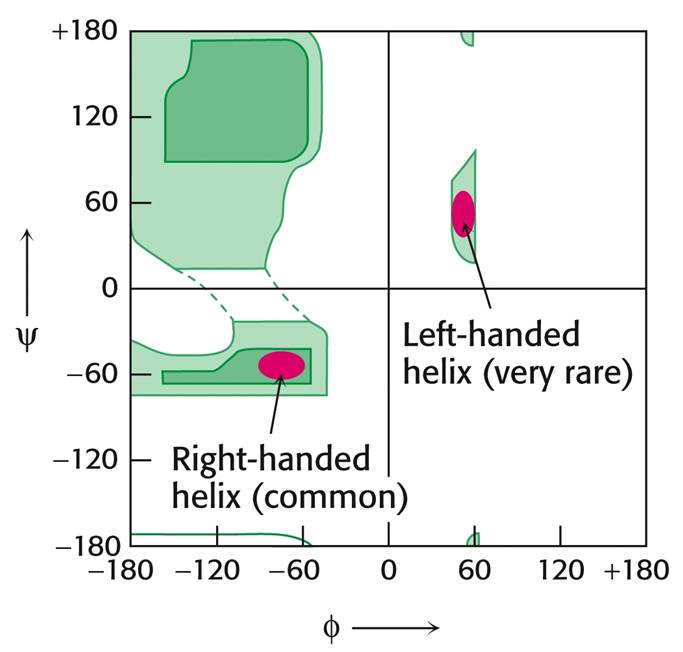
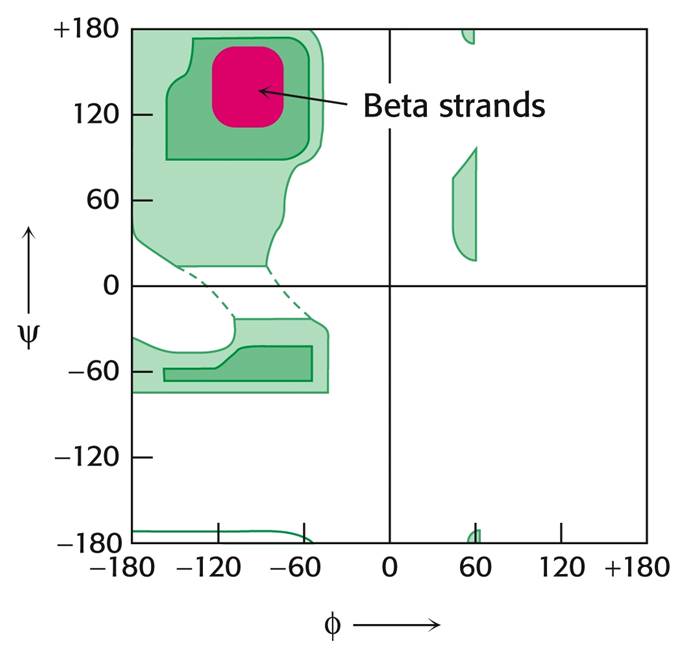
α-спираль, расположение водородных связей и дистанции:
β-складка, расположение водородных связей:
Антипараллельная
Параллельная
Надвторичная структура типа coiled-coil
Надвторичная структура типа лейциновой молнии
Надвторичная структура: Zn-палец и EF-рука
6. Третичная структура белка
Доменная организация белков:
1) α-спиральный домен иβ-складчатый домен
| α-спиральный домен | β-складчатый домен |
2) αβ-домены с повернутыми β-складками и αβ-домен с β-бочкой в центре
| αβ-домены с повернутыми β-складками | αβ-домен с β-бочкой в центре |
7. Четвертичная структура белка
Четвертичная структура - надмолекулярная (субъединичная) организация
| Полипролиновая спираль коллагена | Микротрубочки | Актин |
8. Фолдинг полипептидной цепи
Укладка амиконислот в цепи и далее в структуры более высоких уровней, упаковка белка для того, чтобы он мог выполнять свою функцию.
Полипептидная цепь сворачивается стремясь к энергетическому минимуму:
- синтез белка на рибосоме
- роль белков теплового шока
- прионы и амилоиды
9. Методы очистки белков
1) Диализ
2) Ультрацентрифугирование
3) Гель-фильтрация
4) Ионообменная хроматография
5) Хроматография по сродству (affinity)
6) Анализ и детекция: гель-электрофорез
7) Анализ и детекция: антитела
- вестерн-блот
- иммунофлуоресцентный анализ
- иммуноферментный анализ
8) Комбинация электрофореза и изоэлектрофокусирования: двумерное разделение
9) Принцип метода масс-спектрометрического определения массы белков и пептидов
10) Анализ пространственной структуры белка: рентгеноструктурный анализ
Белок нужно исследовать в состоянии кристалла (кристализованная форма)
* Зеленый флуоресцентный белок (GFP) - природный флуорофор без простетической группы
11) Анализ пространственной структуры белка: ЯМР-спектроскопия
Анализируется третичная структура в растворе
































































