Семинар 6. Ферменты
- Подробности
Часть 1. Структура-функция: Биокатализаторы, Специфичность, Механизмы действия, Регуляция.
1. Три основных свойства отличают ферменты от химических катализаторов:
- Каталитическая сила
- Специфичность
- Наличие регуляции
Все ферменты одинаково ускоряют как прямую, так и обратную реакции !!!
2. Каталитическая сила
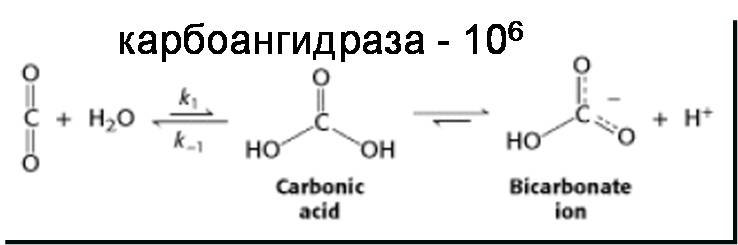
3. Специфичность - Определяется наличием активного центра и образованием фермент-субстратного комплекса
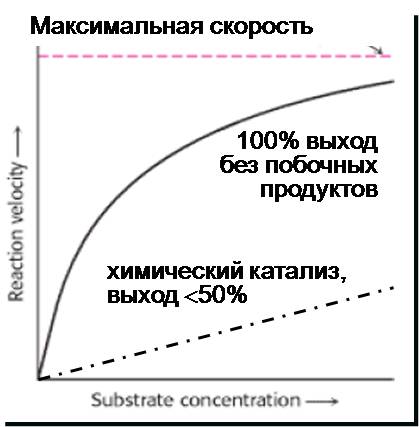
- Максимальная скорость
- Кристаллография
- Спектральные отличия
4. Фермент-субстратный комплекс
| Ключ-замок Рука-перчатка |
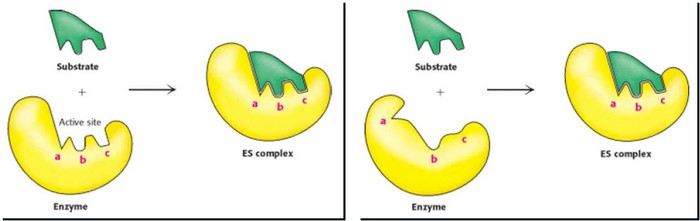 |
- Формируется разными частями белка
- Представляет собой углубление или разрез
- Имеет относительно небольшой размер
- Реализует слабые взаимодействия при связывании
- Специфичность определяется точной ориентацией атомов
5. Переходный (transition-state) комплекс
6. Стратегии ферментативного катализа
- Использование и стабилизация переходного комплекса
- Дестабилизация субстрата в фермент-субстратном комплексе
- Снижение энтропийного фактора
- Сближение и ориентация
- Кислотно-основной катализ
- Ковалентный катализ
- Катализ с участием ионов металлов
7. Использование переходного комплекса
Главная цель - снижение свободной энергии активации Гиббса
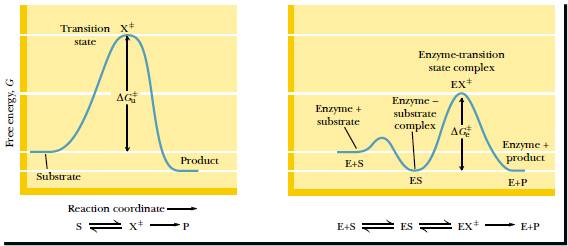
Ускорение реакции ферментом происходит только в случае DGe# < DGu#
8. Энтропийный фактор и энергия связывания ES
| Справа: Энергия связывания фермент-субстратного (ES) комплекса (DGb) частично компенсируется уменьшением энтропии (TDS) и дестабилизацией ES (DGd) за счет напряжения, изменения конформации и вытеснения растворителя. Без такой компенсации - пунктирная линия. | 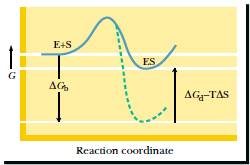 |
| Слева: катализ не пойдет если ES и EX# одинаково стабилизированы (их DGb равны), но пойдет в случае компенсации за счет DGd и TDS при дестабилизации ES (справа). |
9. Механизмы дестабилизации субстрата
Уменьшение энтропии, Десольватация, Электростатическая дестабилизация
10. Сближение и ориентация
Прямое уменьшение энтропии в случае бимолекулярной реакции
11. Кислотно-основный катализ
Механизм действия РНКазы
По определению, при кислотно-основном катализе в переходном состоянии происходит перенос протона.
При специфическом - участвует вода, она является донором протона.
При общем - донор может быть любым, например, буфер.
* Такой же механизм действия у протеаз - химотрипсин, пепсин и др.
12. Ковалентный катализ
Ковалентный катализ означает, что реакция типа

идет с образованием ковалентного интермедиата
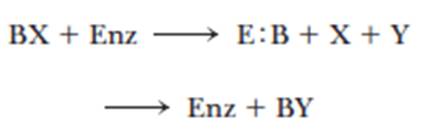
и подчиняется нуклеофильному или электрофильному механизму.
13. Энергетический профиль катализа химотрипсином
Постулируется наличие двух переходных комплексов с одним интермедиатом
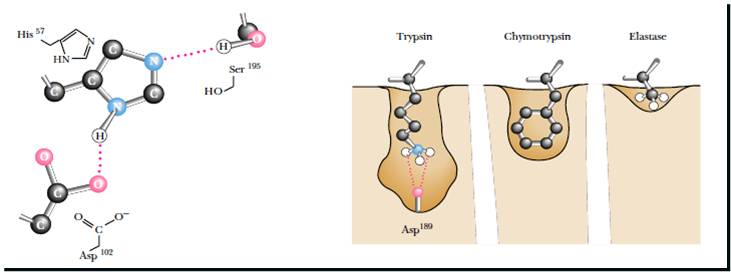
14. Каталитические механизмы протеаз
Триадный катализ - сериновые протеазы (трипсин, химотрипсин, тромбин, плазмин, субтилизин, эластаза, активаторы плазминогена)
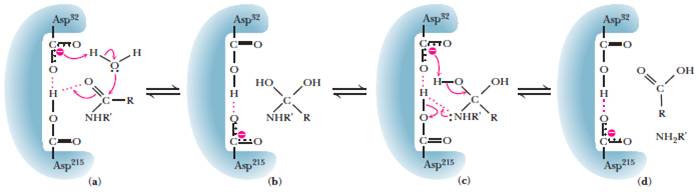
Диадный катализ - аспартатные протеазы (пепсин, химозин, катепсин, ренин, протеаза вируса СПИДа)
15. Стратегии регуляции активности ферментов
- За счет концентраций субстрата/продукта
- Под действием метаболитов
- При помощи ковалентной модификации
- Белок-белковыми взаимодействиями
- Аллостерически
- Ограниченным протеолизом
- Изменением уровня экспрессии
- Изменением изоформного состава
16. Основной принцип регуляции метаболитами
Регулируется первая необратимая стадия процесса
17. Ковалентная модификация
18. Множественная модификация ключевых белков
| Гистон Н3 | белок P53 |
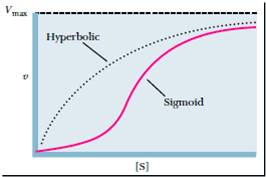
19. Аллостерическая регуляция
На примере миоглобина-гемоглобина
20. Ограниченный протеолиз
21. Активация химотрипсиногена



















