Электромеханическое сопряжение в скелетных мышцах и в миокарде. Классификация и функции рианодиновых рецепторов.
- Подробности
Особенностью электромеханического сопряжения в сердечной мышце является то, что при возбуждении миокарда ионы кальция поступают в саркоплазму не только из цистерн саркоплазматического ретикулума, но также из Т-трубочек. Без этого дополнительного источника ионов кальция сокращение сердечной мышцы было бы недостаточно сильным. Дело в том, что в отличие от скелетной мышцы саркоплазматический ретикулум в кардиомиоцитах развит слабее.
Что касается системы Т-трубочек, то они являются мощным депо кальция. Их диаметр в 5 раз, а объем жидкости в них в 25 раз больше, чем в волокнах скелетных мышц. Кроме того, в Т-трубочках имеется большое количество мукополисахаридов, несущих на поверхности отрицательный заряд. Связываясь с ионами кальция, они создают значительный запас этих ионов, способных немедленно диффундировать в саркоплазму при возбуждении.
Сила сокращения кардиомиоцитов зависит от внеклеточного кальция, а скелетных мышц - нет.
В отличие от скелетных мышц сила сокращения миокарда в значительной степени зависит от концентрации кальция во внеклеточной жидкости. Дело в том, что хорошо развитая система Т-трубочек, открываясь в окружающее внеклеточное пространство, заполнена внеклеточной (интерстициальной) жидкостью с высоким содержанием кальция. Таким образом, внеклеточная жидкость проникает глубоко внутрь волокон по системе Т-трубочек и служит необходимым источником ионов кальция для развития мышечного сокращения.
Сила сокращения скелетных мышц практически не зависит от изменений концентрации кальция во внеклеточной жидкости. Сокращение скелетных мышц полностью обеспечивается ионами кальция, поступающими в саркоплазму из цистерн саркоплазматического ретикулума, т.е. из внутриклеточных источников.
В конце фазы плато потенциала действия вход ионов кальция в кардиомиоцит прекращается. Из саркоплазмы ионы кальция быстро удаляются как обратно в саркоплазматический ретикулум, так и во внеклеточную жидкость Т-трубочек. В результате цикл сокращения в миокарде завершается вплоть до поступления нового потенциала действия.
Длительность сокращения скелетных и сердечных мышц.
Сокращение сердечной мышцы начинается через несколько миллисекунд после начала потенциала действия и заканчивается через несколько миллисекунд после завершения потенциала действия. Таким образом, длительность сокращения миокарда зависит от длительности потенциала действия, включая фазу плато, и составляет 0,2 сек в миокарде предсердий и 0,3 сек в миокарде желудочков.
Рианодиновый рецептор (RyR).
Рианодиновый рецептор (RyR) в мышечных клетках выполняет важнейшую функцию сопряжения потенциала действия с мышечным сокращением. В скелетных мышцах рианодиновые рецепторы активируются посредством специализированного механизма прямого электромеханического сопряжения, а сокращение сердечной мышцы запускается по механизму Са2+-индуцированного выброса Са2+.
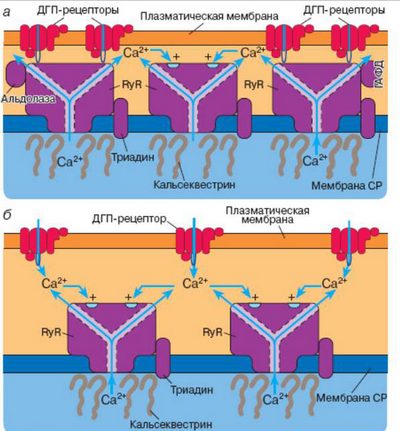
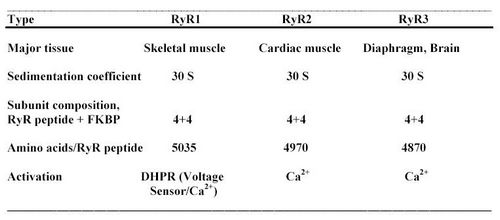
Обнаружено три изоформы рианодинового рецептора: RyR1 , RyR2 , RyR3 , кодируемые тремя разными генами. RyR имеют несколько мест регуляции, которая осуществляется Са2+ , АТР , кальмодулином (КМ) , иммунофилином и кальцинеурином . Рецептор фосфорилируется CaKMPK II (CaKM-зависимая протеинкиназа II) и дефосфорилируется кальцинеурином. В скелетных мышцах RyR1 расположен на цистернах СР примыкающих к цитоплазматической мембране и его длинный цитоплазматический "хвост" (так называемый "foot"-регион, или "ножка") соприкасается с дигидроперидиновым рецептором (DHPR) на плазмалемме. Однако, непосредственное функциональное взаимодействия между RyR и DHPR на молекулярном уровне еще не показано. Обсуждается вопрос об участии третьего белка в образовании контакта между RyR и DHPR.
Согласно разным структурным моделям С-конец RyR содержит от до 10 (12) трансмембранных доменов, формирующих мембранную пору. Активность RyR модулируется растительным алкалоидом рианодином из коры Ryania speciosa, что и определило его название. На каналы изолированные из мышц позвоночных и ракообразных рианодин в концентрациях от нМ до мкМ оказывает активирующее влияние, тогда как в концентрациях выше 100 мкМ он вызывает полное закрывание каналов. Было постулировано, что рианодин связывается с каналом в открытом состоянии. Физиологическим активатором рианодинового рецептора, в частности его сердечной изоформы и рианодин-чувствительного Ca2+- канала яйцеклеток морских ежей является циклическая АДР-рибоза (сADPR ) - наиболее мощный из известных Са2+-высвобождающих агентов. Полумаксимальное высвобождение Са2+ в гомогенатах яйцеклеток морских ежей наблюдается при наномолярных концентрациях сADPR, что на порядок ниже, чем для IP3. Крутая зависимость активности RR от концентрации Са2+ (см рис. 6.8 ) позволяет говорить о механизме выброса Са2+ в присутствии cADPR как о Са2+-индуцированном выходе Са2+.
CaКM-зависимая протеинкиназа фосфорилирует все три изоформы рецептора, что приводит к его активации. Показано, что PKA и GMP-зависимая протеинкиназа также способны фосфорилировать этот же сайт. Фосфорилирование этого сайта cAMP-зависимой протеинкиназой, в частности при стимуляции b-адренорецептора , активирует сердечную изоформу RyR.
Генерация Са2+-сигнала с участием cADPR, в настоящее время показана для ряда тканей и клеток, для млекопитающих и растений. У млекопитающих активация секреции везикул ацинарными клетками поджелудочной железы и секреции инсулина b-клетками весьма чувствительны к подъему Са2+, вызванному именно этим циклическим нуклеотидом.
Краткое резюме по рианодиновым рецепторам:
Рианодиновые рецепторы(RyR) представляют собой особый тип хемоактивируемых Са2+каналов, имеющихся в мембране СР. Для млекопитающих известны 3 изоформы:RyR1,RyR2,RyR3. Нокаут гена:RyR1иRyR2–смерть в период эмбрионал разв-я.RyR3–жизнеспос-ые живот; значит-ое сниж-е CICR .Для скел м-ц:бол-во RyR1 спарены с DHPR. Более значит-ым оказыв мех-м DICR.Для сердеч м-цы:тока один из 5-10 RyR2 спарен с DHPR. Большее знач играет мех-зм CICR. Работы Фабиато: Суть: Налич отриц-ой обр-ой св, представлен Ca2+-зависимой инактив-ей RyR. Мех-м: Активацион сайт хар-ся выс акт-ью и низк сродством. Инактив-ый сайт хар-тся низкой акт-ью и выс сродством. Повыш-е конц-ции Ca2+ прив-ит к повыш-ю сродства к агонистам у RyR. Опыты с трипсином подтверд сущест-ие как полож-ой так и отриц-ой регул. Мех-мы взаимод-я: Прямое,с участками внутрен доменов RyR.Ч/з белки-посредники. Действие на наруж участки RyR. В сост RyR входит от 80 до 100 остат цистеина, мн из кот м.б.подвергнуты модиф-ции. Дей-е ок-ей: Подав-е функц-ой акт-ти. Сниж-е способ-ти к регул другими факторами. Модификация с пом NO:В мал конц-ях–повыш актив-ть RyR. В выс-их–понижает акт-ть RyR.



